

BIOLOGÍA Y GEOLOGÍA
BASE MOLECULAR DE LA VIDA
4. PROTEÍNAS
Son biomoléculas de elevado peso molecular formadas por combinación de unos 20 monómeros diferentes llamados aminoácidos. Son la biomoléculas más abundantes en los seres vivos, las más variadas y las de mayor número de funciones.4.1. AMINOÁCIDOS PROTEICOS
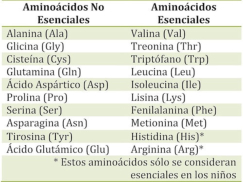
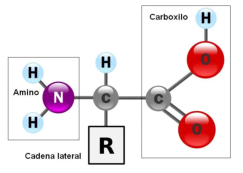
Aunque existen muchos más, en las proteínas sólo se encuentran 20 aa diferentes: los aa proteicos. Están formados por un carbono central (C α ) que se une a un grupo amino (-NH 2 ), un grupo ácido (-COOH), un hidrógeno (-H) y una cadena lateral (R) variable. De los 20 aa, los humanos sólo sintetizan 12 en adultos y 10 en la infancia (y en embarazadas). El resto ha de tomarse con la dieta: aa esenciales (treonina, metionina, lisina, valina, triptófano, leucina, isoleucina y fenilalanina + histidina y arginina). Carnes, huevos y lácteos tienen todos los aa esenciales. También pueden obtenerse combinando legumbres y cereales. Como el C α es asimétrico (salvo en la glicina), los aa tienen estereoisomería (enantiómeros D y L) y son ópticamente activos (dextrógiros y levógiros). En las proteínas sólo hay aa L (D en bacterias y antibióticos). Son anfóteros, actúan como ácidos y como bases. En disolución, el grupo amino y el ácido (así como algunas cadenas laterales) están ionizados, formas zwitteriónicas. Algunos aa o derivados intervienen en la comunicación celular, como neurotransmisores o como hormonas. 4.1.1. CLASIFICACIÓN Se clasifican según la polaridad de las cadenas R laterales: apolares (alifáticos y aromáticos), polares sin carga y polares con carga (ácidos y básicos). Apolares: cadena R con grupos hidrófobos que se unen a otros por fuerzas de Van der Waals. Pueden ser: Alifáticos: R es alifática. Glicina (Gly) G, alanina (Ala) A, valina (Val) V, isoleucina (Ile) I, metionina (Met) M (con azufre), prolina (Pro) P y leucina (Leu) L. Aromáticos: R con anillos aromáticos. Fenilalanina (Phe) F y triptófano (Trp) W. Polares sin carga: R con grupos polares que pueden formar puentes de H. Serina (Ser) S, treonina (Thr) T, tirosina (Tyr) Y, cisteína (Cys) C (con S), glutamina (Gln) Q y asparagina (Asn) N Polares con carga ácidos: R tiene grupos carboxilo (aniones). Ácido aspártico (aspartato) (Asp) D y ácido glutámico (glutamato) (Glu) E. Polares con carga básicos: R tiene grupos amino (cationes). Lisina (Lys) K, arginina (Arg) R e histidina (His) H.4.2. NIVELES DE ORGANIZACIÓN DE LAS PROTEÍNAS
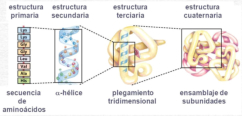
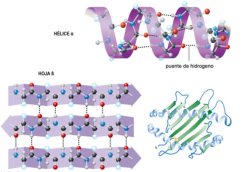
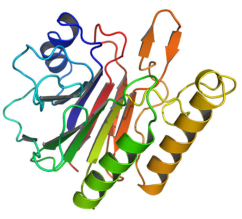
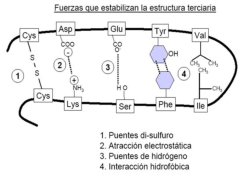
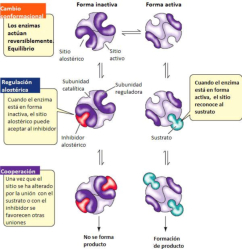
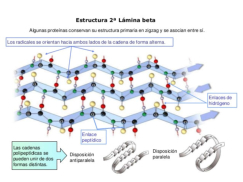
La funcionalidad de las proteínas depende de su estructura tridimensional o espacial, la cual presenta cuatro niveles de organización: estructuras primaria, secundaria, terciaria y cuaternaria. 4.2.1. ESTRUCTURA PRIMARIA Es la formada por la secuencia de aa. Los aa se unen por enlace peptídico, unión entre el amino de un aa y el carboxilo de otro, con pérdida de H 2 O. Se forma así un péptido: dipéptido, tripéptido,…, polipéptido. Péptido (<10 aa); polipéptido (<100 aa); proteína (>100 aa). (La mayor proteína conocida es la titina o conectina, implicada en la contracción muscular y que, en humanos, tiene 34.350 aa, pesa 3.816.188,13 Da, su fórmula empírica es C 169 723 H 270 464 N 45 688 O 52 243 S 912 . El nombre oficial completo dado por la IUPAC a esta proteína en humanos, que comienza por methionyl... y termina por ...isoleucine, contiene 189,819 letras y podría considerarse la palabra más larga del mundo en cualquier idioma). Toda cadena peptídica tiene un extremo amino (N-terminal) y otro carboxilo (C-terminal). Se considera que la cadena empieza en el N- terminal y acaba en el C-terminal. Su esqueleto común es la secuencia repetida de 6 átomos: -NH-CH-CO- y difieren en la cadena lateral R. La estructura primaria viene así definida por el número, tipo y secuencia de los aa. Las cadenas peptídicas pueden rotar alrededor de los enlaces C-C α y N-C α , pero no alrededor del enlace peptídico, que tiene carácter de doble enlace. Por ello, los átomos del enlace peptídico están en un mismo plano y le da a la cadena un aspecto de placas planas articuladas. 4.2.2. ESTRUCTURA SECUNDARIA A medida que la cadena polipeptídica se sintetiza en los ribosomas, se va plegando para adquirir la estructura tridimensional más estable. Es este plegamiento intervienen proteínas llamadas chaperonas. La estructura secundaria es la conformación espacial de la cadena polipeptídica, unida por puentes de H entre los grupos –C=O de unos enlaces peptídicos y los –NH de otros enlaces. La estructura secundaria puede tomar una forma irregular (enroscamientos aleatorios), pero habitualmente adopta una de dos estructuras: α-hélice o β-laminar. 4.2.2.1. Conformación α-hélice La sucesión de aa de la estructura primaria se enrolla sobre sí misma en forma de hélice. Como las cadenas R no intervienen en los enlaces, esta conformación puede adoptarse por proteínas muy diferentes. Algunos aa desestabilizan la hélice debido a su tamaño, sus cargas o su estructura (prolina: su amina es secundaria). 4.2.2.2. Conformación β-laminar La cadena polipeptídica queda extendida y se pliega sobre sí misma, con fragmentos paralelos y antiparalelos enfrentados y unidos por puentes de H. Queda una lámina plegada en zigzag. En ciertas proteínas, como la fibroína de la seda, puede haber, además, puentes de H entre cadenas diferentes. 4.2.2.3. Hélice de colágeno Es una variedad de estructura secundaria. Consiste en tres hélices levógiras enrolladas entre sí. Se produce por el gran número de aa prolina. 4.2.3. ESTRUCTURA TERCIARIA Estructura espacial definitiva de la proteína con regiones en α-hélice y β-laminar mezcladas. La estructura se mantiene por enlaces débiles: puentes de H, fuerzas electrostáticas, fuerzas de Van der Waals y, en algunos casos, puentes disulfuro. El resultado puede ser: Proteínas fibrosas o filamentosas: estructura simple, alargada, resistente e insoluble. Las cadenas R tienen pocos grupos polares y apenas intervienen. Colágeno, queratina, fibroína. Proteínas globulares: esferoidales, compactas y solubles. Como suelen estar en disolución, las cadenas laterales hidrófobas se sitúan al interior de la proteína (láminas β) y las polares al exterior, en contacto con el agua (hélices α). En las proteínas de las membranas, el ambiente es lipídico y la disposición, inversa. 4.2.4. ESTRUCTURA CUATERNARIA Consiste en la asociación de varias cadenas polipeptídicas para formar una proteína compleja. La unión entre cadenas se da por los mismos enlaces que en la terciaria. En proteínas fibrilares se forman complejos supramoleculares con forma alargada y función estructural: queratina, colágeno. En proteínas globulares la estructura cuaternaria la forman proteínas con estructura terciaria compleja. Las cadenas polipeptídicas se autoensamblan en la célula, formando dímeros (citocromo c), tetrámeros (hemoglobina) y, en general, oligómeros y polímeros (actina y miosina, microtúbulos, ribosomas, cápsida de virus, etc). Estructura 4 ria y funcionalidad: la estructura 4 ria (o 3 ria en las que no tienen 4 ria ) es responsable de su actividad biológica. Dado que, en última instancia, toda estructura depende de la secuencia de aa, cualquier cambio en esta puede afectar a la funcionalidad. De las casi infinitas posibles proteínas existentes, las actuales son las que probaron ser útiles para las funciones celulares y la evolución las mantuvo, eliminando a las menos eficaces. Alosterismo: algunas proteínas presentan dos tipos de estructura espacial, un estado activo y otro inactivo, debido a cambios conformacionales en respuesta a cambios de pH o de temperatura. Las proteínas alostéricas presentan esos estados, pero gracias a la unión con moléculas llamadas ligandos, que modifican su estructura espacial. El alosterismo es uno de los mecanismos más eficaces para regular la función de una proteína, activándola o inactivándola según las necesidades.4.3. PROPIEDADES DE LAS PROTEÍNAS
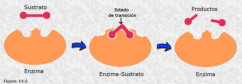
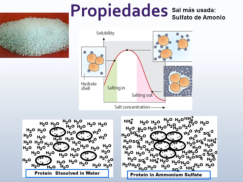
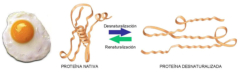
Las propiedades físicas y químicas de las proteínas dependen en última instancia de la secuencia de aa, ya que serán las cadenas R las que determinen la estructura tridimensional y la funcionalidad. 4.3.1. ESPECIFICIDAD Las proteínas presentan una superficie o centro activo, formado por grupos funcionales de algunas cadenas laterales R de su superficie que les permite interaccionar con otras moléculas. El resto de la proteína tiene como función mantener la forma apropiada para que la superficie activa esté en posición correcta. La actividad biológica de las proteínas se basa en la unión selectiva del centro activo con moléculas que encajan perfectamente en él. Pueden ser moléculas iguales (otras proteínas) o diferentes (anticuerpo-antígeno, hemoglobina-oxígeno, enzima-sustrato, receptores de membrana-mensajero). Esta característica de unión selectiva se llama especificidad y depende de la secuencia de aa. Cualquier cambio en esta secuencia alterará la estructura tridimensional de la proteína y su funcionalidad (como en la anemia falciforme). 4.3.2. SOLUBILIDAD Las proteínas globulares son solubles debido a sus cargas, que atraen al agua, formando una capa de solvatación. La presencia de sales como el sulfato de amonio ((NH 4 ) 2 SO 4 ) en gran cantidad provoca la precipitación de las proteínas al competir los iones NH 4 + y SO 4 - por el agua. 4.3.3. DESNATURALIZACIÓN Es la pérdida de la conformación espacial, que conlleva la pérdida de funcionalidad. Se produce en condiciones desfavorables (temperatura, pH, iones, agentes químicos, presión, electricidad…). Las proteínas se convierten en filamentos fibrosos insolubles (huevo cocido, melanina en el gato siamés). Si las condiciones desfavorables duran poco tiempo o son poco intensas, la desnaturalización puede ser reversible y la proteína recuperar su estructura y función (renaturalización). En otros casos es irreversible.4.4. CLASIFICACIÓN DE LAS PROTEÍNAS
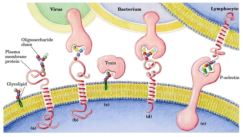
4.4.1. HOLOPROTEÍNAS Formadas sólo por aa. Pueden ser: Globulares: esféricas y solubles. Albúminas: función de reserva y transporte (ovoalbúmina, lactoalbúmina y seroalbúmina). Globulinas: incluyen las α y β globulinas (hemoglobina), y las γ-globulinas de los anticuerpos. Histonas y protaminas: unidas a los ácidos nucleicos. Enzimas: en reacciones metabólicas. Fibrosas o escleroproteínas: insolubles, estructurales: colágeno, queratina, elastina, fibroína. 4.4.2. HETEROPROTEÍNAS O PROTEÍNAS CONJUGADAS Llevan un grupo proteico y una parte no proteica (grupo prostético). Glucoproteínas: glucoconjugados. Proteínas de membrana, mucus, gammaglobulinas (anticuerpos), hormonas, … Lipoproteínas: proteínas sanguíneas que transportan triglicéridos, colesterol y otros lípidos. Cromoproteínas: el grupo prostético es una sustancia coloreada. De naturaleza porfirínica: llevan porfirina (con anillos tetrapirrólicos). Grupo hemo de hemoglobinas, con Fe, citocromos, clorofilas, … De naturaleza no porfirínica: Sin porfirina. Hemocianina (con Cu) y hemeritrina (con Fe) en sangre de invertebrados, rodopsina de la retina. Otras heteroproteínas: fosfoproteínas (con ácido fosfórico: caseína) y nucleoproteínas (cromatina: ADN + histonas y protaminas).4.5. FUNCIONES DE LAS PROTEÍNAS
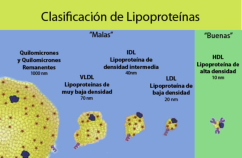
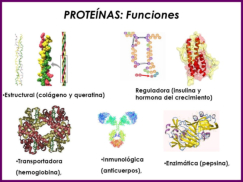
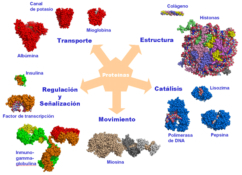
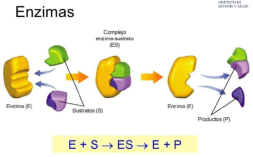
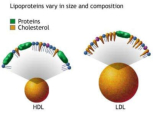
Reserva: no suelen ser combustibles. Ovoalbúmina, caseína. Estructural: una función típica. Glucoproteínas (membranas). Huso acromático y citoesqueleto. Histonas (estructura y regulación del ADN). Colágeno (tejido conjuntivo: relleno, cartílago, tendones…) Homeostática: actúan como tampones o sistemas buffer, regulando el pH. Portadoras de mensajes: hormonas (insulina, glucagón, hormona del crecimiento, oxitocina, vasopresina…). Neurotransmisores: endorfinas y encefalinas. Recepción y transmisión de señales: actúan como receptores de membrana. Se unen a una molécula portadora de un mensaje (neurotransmisor, hormona,…) y sufren un cambio conformacional que es una señal para provocar una respuesta (apertura de canales iónicos, estimulación de mitosis, incremento de síntesis de proteínas…). Las señales pasan de las membranas al citoplasma por un sistema de transducción de señales mediante proteínas alostéricas que sufren activación en cascada. Transporte: transporte a través de membranas (proteínas de canal); oxígeno (hemoglobina, hemocianina, mioglobina); electrones (citocromos en respiración y fotosíntesis); lípidos, fármacos y tóxicos (seroalbúmina). Destacan las lipoproteínas plasmáticas, que transportan lípidos en sangre: Quilomicrones: transportan triacilglicéridos y colesterol de la dieta, desde intestino a hígado. VLDL y LDL: transportan triacilglicéridos y colesterol sintetizados desde el hígado a los tejidos (“colesterol malo”). HDL: transportan colesterol desde tejidos al hígado (“colesterol bueno”). Defensa: coagulación (trombina y fibrinógeno); germicidas (proteoglucanos o mucinas); anticuerpos (inmunoglobulinas). Contráctil: son los motores moleculares, proteínas que se desplazan unidireccionalmente por el citoesqueleto. Transportan orgánulos, vesículas; mueven a las células (dineína de cilios y flagelos; actina y miosina en músculos). Enzimática: quizá la más importante. Las más numerosas y especializadas. Son biocatalizadores del metabolismo. Son específicas de las reacciones y sustratos que catalizan. La vida depende de la actividad catalítica, que acelera las reacciones químicas.


















































Para ir a donde no se sabe hay que ir por donde no se sabe.” San Juan de la Cruz
“It must be a strange world not being a scientist, going through life not knowing--or
maybe not caring about where the air came from, where the stars at night came from or
how far they are from us. I WANT TO KNOW” Michio Kaku
“Nullius in verba” Robert Boyle, Christopher Wren y Robert Hooke












Composición musical derivada de la secuencia de aa de la proteína de unión al ADN Ikaros
Compositor: Kirsten Mossberg
Animación: Blair Lyons




Paganini: ¿síndrome de Marfan?
El cambio de una única base en el ADN provoca la anemia
falciforme










BASE MOLECULAR DE LA VIDA













































![Cerrar [x]](bg2bto_htm_files/close.png)









